Vorbemerkung: Der Franck-Hertz-Versuch ist ein
Beispiel dafür, wie Gegenstände in der Atomphysik untersucht werden
können: Man schickt irgendeine Strahlung (hier Elektronen) auf den
Untersuchungsgegenstand und schaut, wie dieser auf die Strahlung
reagiert ("Streu-Versuch"). Eine andere Möglichkeit
besteht darin, dem Untersuchungsgegenstand Energie zuzuführen und zu
schauen, welche Strahlung er dann abgibt ("Spektroskopie").
Der Versuch:
|
|
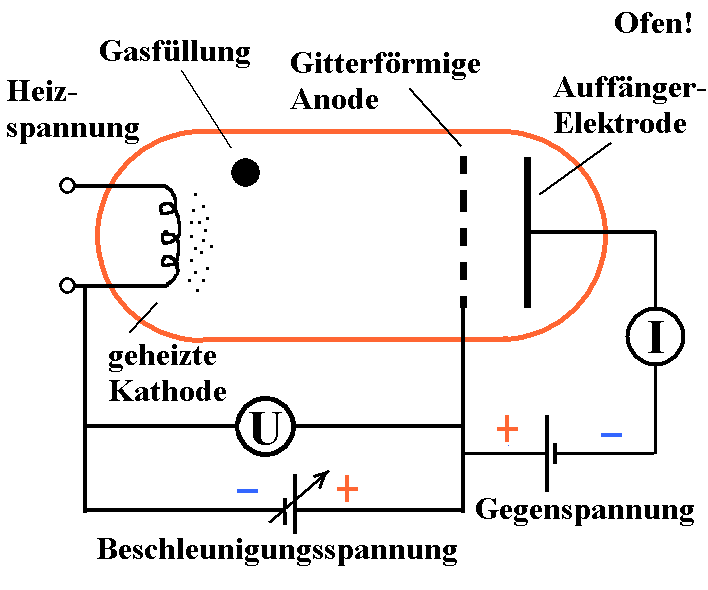
Abb. 1: Anordnung schematisch
Beim Franck-Hertz-Versuch besteht der
Untersuchungsgegenstand aus Atomen (Quecksilber, Neon oder
andere). Sie werden mit Elektronen beschossen. Das Gas ist ein
einem Glaskolben enthalten, der auch noch einige Elektroden
enthält.
Das ist einmal eine Glühkathode, aus der
Elektronen herausgedampft werden, dann eine gitterförmige und
damit durchlässige Anode und eine Auffänger-Elektrode. Zwischen
Anode und Auffänger-Elektrode wird ein kleines elektrisches
Gegenfeld angelegt. Der Glaskolben befindet sich evtl. in einem
geheizten Ofen. So wird dafür gesorgt, dass ein geeigneter
Gasdruck im Glaskolben entsteht. Zwischen Kathode und Anode
werden die Elektronen beschleunigt. Dabei treffen sie auf Atome
des Gases. In der Regel führen sie elastische Stöße aus, bei
denen wegen des großen Massenunterschieds zwischen Elektronen
und Atomen nur wenig Energie übertragen wird. In besonderen
Fällen aber können die Elektronen inelastische Stöße mit den
Atomen ausführen, wobei sie an diese (innere) Energie
übertragen, sie "anregen".
|
Gemessen wird der Auffängerstrom I in Abhängigkeit von
der Spannung U zwischen Anode und Kathode, der Anoden-Spannung oder
Beschleunigungsspannung.
I hängt nämlich stark von dieser Anoden-Spannung U ab und
verrät dadurch Eigenschaften der Atome. Elektronen nehmen die kinetische
Energie e·U auf. Wenn diese so ist, dass den Elektronen eine Anregung
der Gasatome gelingt, verlieren sie kinetische Energie und können evtl.
nicht mehr gegen das Gegenfeld zur Auffänger-Elektrode gelangen. Dann
fließt höchstens ein kleiner Auffängerstrom I. Ist die Anodenspannung U
jedoch so, dass die Elektronen die Gasatome nicht anregen können,
verlieren sie kaum Energie und können gegen das Gegenfeld anlaufen. Es
fließt dann ein relativ hoher Auffängerstrom.
Der Versuch dient zum
Nachweis dafür, dass Atome feste Energiestufen besitzen.
Ein Nebeneffekt des Versuchs ist die Messung
des Energieabstands zweier Energiestufen im untersuchten
Atom. Dieser stimmt mit der Photonenenergie überein, wenn
das Atom die aufgenommene Energie unter Emission eines
Photons wieder abgibt.
|
[Für das Wasserstoff-Atom hatte das Bohr schon früher
entdeckt aufgrund der Frequenzen der Spektrallinien.(spektroskopische
Messungen z.B. durch Balmer)]
.
Du solltest die I-U-Kurve ausmessen und dabei bzw.
anschließend folgende Beobachtungen machen:
1. Grob gilt die Tendenz: Je größer die Anodenspannung
(Beschleunigungsspannung), desto größer ist der Auffängerstrom. Das
hängt mit der Raumladungswolke zusammen, die sich in der Nähe der
geheizten Kathode bildet. Je größer die Anodenspannung U, desto mehr
Elektronen werden aus der Raumladungswolke herausgesaugt und
beschleunigt.
2. Der tendenzielle Anstieg des Auffängerstroms wird immer
wieder unterbrochen. Ist die Anodenspannung (Beschleunigungsspannung) U
zu klein, erreichen die Elektronen keine Energie, mit der sie die
Gasatome anregen könnten. Sie stoßen mit ihnen höchstens elastisch und
behalten ihre kinetische Energie, mit der sie hinter der Anode gegen die
Gegenspannung anlaufen können. Bei genügender Anodenspannung dagegen
können die Elektronen Atome bei inelastischen Stößen anregen und
verlieren ihre Energie. Solche Elektronen sind dann zu langsam, um gegen
die Gegenspannung anzulaufen.
3. Die I-U-Kurve fällt aber nicht plötzlich ab, sondern
erst allmählich. Nicht alle Elektronen haben nämlich die gleiche
Geschwindigkeit:
Relativ wenige Elektronen haben nach dem Austritt aus der
Raumladungswolke eine sehr große Geschwindigkeit. Sie sind als erste in
der Lage, Atome anzuregen: Der Auffängerstrom sinkt, aber nur wenig.
Erst, wenn - bei höherer Anodenspannung - die Mehrzahl der Elektronen
die Anregungsenergie erreicht hat, sinkt der Auffängerstrom stärker. Bei
einer solchen Anodenspannung werden die wenigen schnellsten Elektronen
aber schon wieder erneut beschleunigt und können wieder gegen die
Gegenspannung anlaufen. Schließlich hat die Mehrzahl der Elektronen
Gasatome angeregt und wird erneut beschleunigt: der Auffängerstrom
steigt erneut kräftig an.
4. Bei Erhöhung der Anodenspannung geschieht das mehrmals
hintereinander. Die Zone innerhalb der Röhre, in der die erste Anregung
passiert, rückt dabei immer weiter von der Anode weg, dann folgt evtl.
eine zweite und dritte Anregungszone, usw. Elektronen, die ihre Energie
an Atome abgegeben haben, werden erneut beschleunigt und können ein
weiteres Mal anregen. Bei der mit Neon gefüllten Röhre kann man einige
dieser aufeinander folgenden Zonen am Leuchten der angeregten Atome
erkennen, wenn diese wieder die zugeführte Energie in Form von Licht
abgeben. Bei Quecksilberatomen entsteht UV-Licht, das z.B. mit einer
UV-empfindlichen Kamera nachgewiesen werden kann. Seine Photonenenergie
stimmt recht gut mit der Anregungsenergie überein.
5. Nahe der Maxima und Minima der I-U-Kurve sind immer
drei Vorgänge überlagert: Die Elektronen, die gerade angeregt haben,
werden erneut beschleunigt und kommen vielleicht gerade wieder zur
Auffängerelektrode. Etwas vorher langsamere Elektronen regen Atome an
und verlieren dabei ihre kinetische Energie, können also nicht mehr zum
Auffänger gelangen. Elektronen, deren Energie zum Anregen noch nicht
ausreicht, treten ungehindert durch die Anode zum Auffänger. Die Maxima
der I-U-Kurve liegen ungefähr bei der Anodenspannung, bei der die
Mehrzahl der Elektronen anregt.
6. Die Maxima der I-U-Kurve haben alle den gleichen
bestimmten Abstand. Miss diesen Abstand aus. Bei einer
Spannungsdifferenz von 2 V würde dies einer Anregungsenergie von 2 eV
entsprechen. Wie groß ist die Anregungsenergie bei der Atomsorte deines
Versuchs? Passt im Fall von Quecksilber bei einer gemessenen
UV-Wellenlänge von ca. 254 nm die Anregungsenergie zur Photonenenergie?
Rechne es nach!
7. Die Heizung der Kathode muss auf einen
geeigneten Wert eingestellt sein, um eine gut strukturierte I-U-Kurve zu
erhalten. Je heißer die Kathode, desto mehr Elektronen werden aus ihr
herausgedampft und sammeln sich in einer Raumladungswolke um die Kathode
herum an.
8. Weder bei zu kleiner Temperatur des Ofens noch
bei zu großer funktioniert der Versuch: Es muss ein bestimmter Gasdruck
durch die Temperatur eingestellt werden.
Der relativ geringe Abstand der zwei beteiligten
Energieniveaus in den verwendeten Atomen und die große
Übergangswahrscheinlichkeit für eine solche Anregung sorgen dafür, dass
in der Regel keine anderen denkbaren Anregungen stattfinden. Die
beobachtete Anregung "kommt sozusagen anderen auch denkbaren Anregungen
zuvor".
Hinweise:
Wegen zusätzlicher Effekte (z.B. Kontaktpotenziale) liegt
das erste Maximum nicht unbedingt bei der Anregungsenergie. Elektronen
können Atome anregen, wenn sie mindestens die Anregungsenergie besitzen.
Licht kann nur anregen, wenn die Photonenenergie genau mit dem
Energieabstand zweier Energieniveaus übereinstimmt. Ein Atom "anregen",
heißt in der Physik "die innere Energie eines Atoms erhöhen".
.
( Juni 2014 )